用途:AquaPen手持式藻类叶绿素荧光测量仪设计轻巧,可在现场或实验室快速、可靠的测量浮游藻类的叶绿素荧光参数。它配备有蓝色和红色LED发射器、光学过滤,并准确地聚焦提供高达3000µmol.m-2.s-1的光。蓝色激发光(455 nm)用于海藻叶绿素激发,橙红色的激发光(630nm处)用于激发藻蓝色素适用于蓝藻测量。AquaPen可以测量自然界水体中低浓度的浮游植物含量,灵敏度高达0.5µg Chl/L,。 测量的数据存储于仪器内部,通过蓝牙或USB与计算机连接,采用专业的FluorPen软件进行数据传输和分析功能,表格和图形显示结果。参数包括FT,QY,NPQ,OJIP分析,光响应曲线,以及在680和720nm的光密度。
AquaPen有两种版本:AquaPen AP 110-C,比色皿式和AquaPen AP 110-P,探头式。

测量原理:利用调制荧光测量技术,内置LED光源,内设测量给光程序测量并计算叶绿素荧光响应的各种参数。
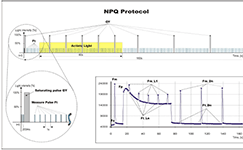
应用领域:
藻类光合特性与代谢研究;
生物与非生物胁迫检测;
藻类抗胁迫能力研究;
湖沼生物学研究;
海洋学研究;
生物工程学
技术规格:
探头主体 | |
测量和计算的参数 | F0 ; FT ; FM ; FM ' ; QY; OJIP; NPQ 1,2; LC 1,2,3; OD680 , OD720等20多个参数 (NPQ1,2:2种给光程序的荧光淬灭曲线;LC1,2,3:3种给光程序的光响应曲线);OD光密度值仅比色皿版本可以测量。 |
饱和光强度 | 0~100%可调,最大3000µmol(photon)/m2.s |
光化光强度 | 10到1000µmol(photon)/m2.s可调 |
测量光 | 蓝色和红色测量光,0~100%可调,最大0.09µmol(photon)/m2/脉冲 |
激发光源 | AP110-C:蓝色 (455 nm)和红橙色(630 nm)LED,光学过滤,精准聚焦; AP110-P:蓝色 (470 nm),其他波长可选。 |
探测波长范围 | PIN光电二极管带667~750nm滤光器 |
FluorPen软件 | 1.1版本,Windows 7或更高 |
存储容量 | 最大16MB |
数据存储容量 | 最大149000个数据点 |
显示 | 2×8字符LCD显示屏 |
按键 | 密封2键 |
自动关机 | 无操作5分钟后自动关机 |
电源 | 可充电锂电池,2000mAh |
电池电量 | 典型情况下可连续操作48个小时,低电量LCD显示 |
尺寸 | 165 mm×65 mm×55 mm |
重量 | 290克 |
样品固定器 | AP110-C:4ml比色皿; AP110-P:潜水式光学探头。 |
工作环境 | 温度0~+50℃,相对湿度0~95%(非冷凝) |
存储环境 | 温度-10~+60℃,相对湿度0~95%(非冷凝) |

案例介绍:
案例1:高温胁迫后,微球藻在生物反应器内荧光参数的恢复。
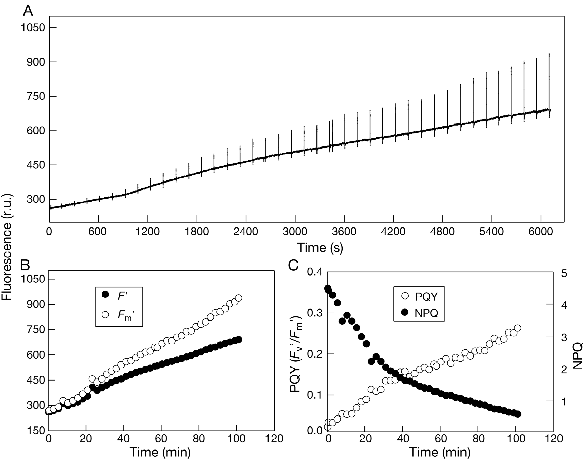
随着恢复时间的延长,NPQ值逐渐降低,同时Fv’/Fm’增加,表明微球藻光合活性得到恢复。
案例2:PAHs(多环芳香烃,致癌物)的浓度及处理时间对两个不同样地的浮游藻类光合活性(Fv/Fm)的影响
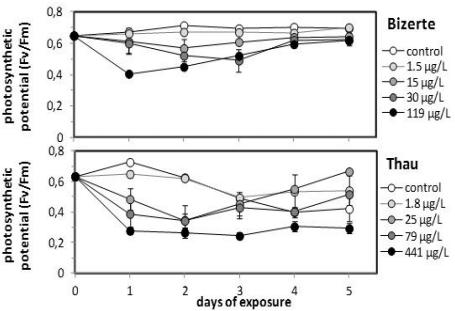
毒性培养24h后,浮游藻类光合活性受到影响。两个地点的最高浓度实验组的Fv/Fm明显下降(从0.65分别下降至0.24和0.4)。其中Thau地区的藻类光合活性始终没有恢复,表明PSII系统受到不可逆损伤;Bizerte地区的经120h后完全恢复。
近期发表文献:
GOIRIS K., VAN COLEN W., WILCHES I. ET AL. (2015): Impact of nutrient stress on antioxidant production in three species of microalgae. Algal Research. Volume 7, Pages 51-57. DOI:10.1016/j.algal.2014.12.002;
DE MARCHIN T., GHYSELS B., NICOLAY S. ET AL. (2014) Analysis of PSII antenna size heterogeneity of Chlamydomonas reinhardtii during state ransitions. Biochimica et Biophysica Acta (BBA) - Bioenergetics, Volume 1837, Pages 121-130. DOI:10.1016/j.bbabio.2013.07.009;
MALAPASCUA J. R. F., JEREZ C. G., SERGEJEVOVÁ M. ET AL. (2014). Photosynthesis monitoring to optimize growth of microalgal mass cultures: application of chlorophyll fluorescence techniques. Aquatic Biology; Volume 22, Pages 123–140. DOI: 10.3354/ab00597; •SALEH M. M., MATORIN D. N., ZAYADAN B. K. ET AL. (2014). Differentiation between two strains of microalga Parachlorella kessleriusing modern spectroscopic method. Botanical Studies, Pages 55-53. DOI: 10.1186/s40529-014-0053-7;
THRANE J. E., HESSEN D. O. AND ANDERSEN T. (2014). The Absorption of Light in Lakes: Negative Impact of Dissolved Organic Carbon on Primary Productivity; Ecosystems. Volume 17: Pages 1040–1052. DOI: 10.1007/s10021-014-9776-2;
THOMMER G., LEYNAERT A., KLEIN C. ET AL. (2013). Phytoplankton phosphorus limitation in a North Atlantic coastal ecosystem not predicted by nutrient load. Journal of Plankton Research. 0(0). Pages 1 – 13. DOI:10.1093/plankt/fbt070;
LAZÁR D, MURCH S. J., BEILBY M. J. ET AL. (2013). Exogenous melatonin affects photosynthesis in characeae Chara australis; Plant Signaling and Behavior. Volume 8(3): e23279. DOI: 10.4161/psb.23279
产地:捷克


