用根部压力室系统测量土壤干燥过程中叶片木质部水势和蒸腾作用
干旱胁迫是植物生产的环境限制因子之一。土壤-植物水力学分析是解释和预测植物在缺水条件下行为的重要手段(Javaux et al., 2008; Sperry et al., 2002)。叶片水势(ψ leaf)被认为是植物水分状况的一个指标,通常用于研究植物对不同土壤和大气干燥的响应(Matin et al., 1989; O’Toole et al., 1984)。
有多种不同的方法被用来测定叶片水势。 Scholander等人(1965)引入了一种压力室,用于在实验室和田间条件下测量植物组织中的水势 (Parent et al., 2010; Richter, 1997;Tyree and Hammel, 1972)。 虽然该方法可以测量不同的植物种类和组织大小, 但它具有破坏性,并且不能在同一植物组织上重复测量(O’Toole et al., 1984)。 采用干湿计连续监测茎叶水势(Iwasaki et al., 2019; Kirkham, 2005; Oosterhuis et al., 1983; Wullschleger et al.,1988), 湿芯和热电偶的敏感性仍然存在问题(Chen and Chen, 2017; Montgomery andMcDowall, 2008)。利用根部压力室来测量叶片水势 (Passioura, 1980),虽然只能在实验室环境下对植物幼株进行测量,但是可以精确的测量出全天或者在土壤变干的几天内叶片水势和蒸腾速率(E)之间的关系(Matzner and Comstock, 2001; Saliendra et al., 1995),利用该技术可以从叶片水势与蒸腾速率的关系中得到植物的水力导度。 (Passioura, 1980)
利用根部压力室, Passioura (1980) 发现在潮湿土壤中小麦的叶片水势和蒸腾速率成线性相关,随着土壤变得 干燥,这种关系转变为非线性相关。 随即在有根毛和没有根毛的大麦中也测得了类似的关系 (Carminati et al., 2017)。高蒸腾速率下干燥土壤叶片水势的下降可以解释为根际水势的下降。这种下降最终限制了根系的供水量,并进一步限制了蒸腾速率,我们的目标是利用根压法调查出土壤水力对蒸腾作用的影响。将这种方法应用在耐旱度高的珍珠粟品系中( Kholovet al., 2010 ),目的是测试新的根部压力室系统在测叶片水势和蒸腾速率关系时的准确性。
实验设备和实验方法
根部压力室系统
根部压力室系统( RPCS)由两个部分组成:一个根压室与上面的试管结合,一个主控制器用于参数调节(图1) 。根压室由钢制成,高31.5cm,内径14.5cm,外径17.5cm。上面的试管由亚克力玻璃制成,高50厘米,内径19厘米,外径20厘米。这些植物种植在PVC管中。然后将样品放置在RPCS中,根和土壤位于压力室中,而芽位于试管中。蒸腾速率是通过调节光照强度来改变的,将进入空气的流速乘以进入空气和排出空气之间的湿度差可以得出蒸腾速率。利用安装在比色皿两端的温湿度传感器( GalltecMela, Bondorf, Germany)每隔10s监测进出空气的相对湿度( RH)和温度。四组发光二极管( LED)灯从外部安装在试管上。光强由辐射传感器( Gamma Scientific, San Diego,USA)在试管顶部内部测量,值范围为0至1180µmol m-2 s-1。通过的空气被安装在辐射传感器上方的风扇搅动。
叶片水势是通过对土壤和根系施加气压,使叶片中的水分达到大气压力而确定的。这个压力被称为平衡压力(P),它对应于木质部的吸力,等于叶片水势的流体静力分量( Passioura, 1980)。来自氮气和压缩空气的压力范围为0-20bar, 分辨率为0.01bar。压力室中的气体调节和调节蒸腾速率的不同参数通过主控制器中的监视器进行控制(图1a) 。 P的测量从密封在压力室中的柱开始。根据土壤的干燥程度,在根部施加大约0 0-3bar的压力,直到被切割的叶子上出现液滴。剪下的叶片随后被夹在毛细管(内径=1mm)上。将活页夹挂在一根垂直拧在试管底部密封盘上的棍子上。该管用于保持叶片和毛细管之间的水力连续性,其中空气-水界面的半月板用红外探测器测量。半月板的位置用来指示植物对施加压力的加压状态。当半月板保持恒定(波动≤ ±2mm)至少1分钟时,确定叶片水势。监视器可以对半月板、进出空气的相对湿度以及施加的压力的变化做出快速反应。
根部压力室灵敏度测试及测定 叶片水蒸腾速率和P
我们比较了根压室系统测量的进气和出气的湿度和温度,并与两个无线温湿度传感器进行了测量。此外,我们比较了从根压室系统的气体交换测量中计算的蒸腾速率与通过天平测量的植物水分损失。为了测试半月板对施加压力的敏感性,在恒定的光照强度下,对土壤和根系施加0.1-0.2bar范围内的一系列压力。

图1. (a)设备外观 和 (b) 根部压力室系统示意图(RPCS).
(b)中的设备草图不是按照实际尺寸绘制的。 氮气和压缩空气的混合物用于施加高压 (P>15 bars), 而氮气仅用于施加较低的压力(P<15 bars). 进入试管的干燥空气或潮湿空气由主控制器中的阀门调节。对一种珍珠谷子品种( Pennisetum glaucum)进行了蒸腾速率和P的测量( Kholov et al.,2010),将它的种子播种在高3cm,内径9.4cm的PVC管中,管内用肥沃的土和石英砂以5:3的比例混合进行填充,混合土被筛至0.1cm。 通过管上直径为5mm的5个孔进行土壤湿度测量, 此外管底均匀分布5 个直径为1 .5mm用于排水的孔。 柱子用0 .8cm厚的铝板覆盖,中间有直径1 .4厘米的播种孔。 在光照时间为14h的气候室中生长,昼夜温度30/18.5℃,昼夜湿度为57/65%,光照强度为600µmol m-2 s-1 13h, 360µmol m-2 s-1 0.5h,三周后将植株的根茎冲洗,晾干一到两天,然后用胶水密封在板孔内( UHU plus Endfest 300, Bòhl,Germany) 。需要注意的是,胶水在短时间内(例如两周)对植物不应有毒,并要能承受高达20bar的压力。通过调节光强来改变蒸腾速率,从100μmol m-2 s-1逐步上升到1000μmolm-2 s-1,然后回落到100 μmol m-2 s-1,每个步骤的测气压的时间约为30-50分钟。土壤水分由时域反射仪(TDR)在加压前后测量(E-Test,Lublin,Poland)。
实验结果
根部压力室系统的灵敏度
图2说明了根部压力室系统测量的总体精度。 根压室系统测得的RH和进风口温度与无线传感器测得的温度匹配良好( r2=0.94and 0.79,respectively)(Figure2a, b)。根压室系统的传感器对温度的微小变化(如0.2℃)更为敏感。根压室系统测得的蒸腾量与天平测得的失水量也吻合得很好( r2=0.96) (Figure 2c)。 植物对光强的响应如图3所示。 在光强增加后1分钟内RHin保持不变, RHout增加,说明光强一变化,植物就开始调节气孔。 RHout的变化表明,完全更换试管内的空气并达到相对稳定的e 需要5 到6 分钟。然而,半月板并不是瞬间变化的,它的反应较慢,有4 到5 分钟的滞后。注意,在半月板显示出明显的移动(例如, 3毫米)之前,压力一直维持在P,这是根据之前的光强确定的。半月板反应滞后的原因可能是由于蒸腾需求增加,叶片水势降低,即从连接的毛细管中吸收水分需要几分钟的时间。
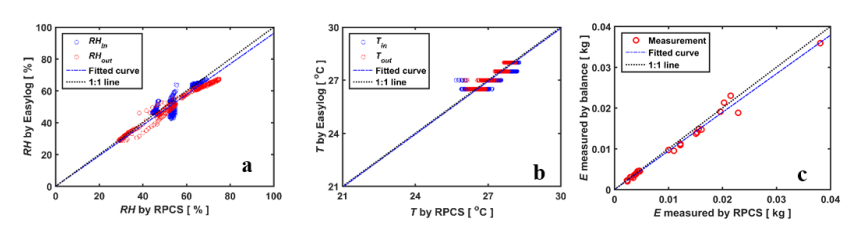
图2. RPCS测得的进入进出空气的(a) 相对湿度 (RH) 、 (b) 温度 (T) 和(c) 通过RPCS和天平 测量的蒸腾作用
半月板对相对较小的压力变化的响应如图4所示。当光强和流量不变时, 根压室系统测得的蒸腾速率是稳定的。压力保持在平衡压力。两分钟后,当压力增加0.1和0.2bar时,半月板上升。 需要注意, 0.1bar是阀门可以控制的最小精确压力。当压力释放并降低到平衡压力时, 半月板停止上升并保持稳定水平。这说明半月板对0.1bar的压力变化很敏感,这又说明压力的测量可以精确到0.1bar。这比Scholander bomb的测量值(0.5bar)和和干湿计的测量值(1bar)要高。 (Model 3115, Soil moisture Equipment Corp, USA; Model600, PMSInstrument, USA), (PSY1 Stem Psychrometer, ICT International, Australia)。
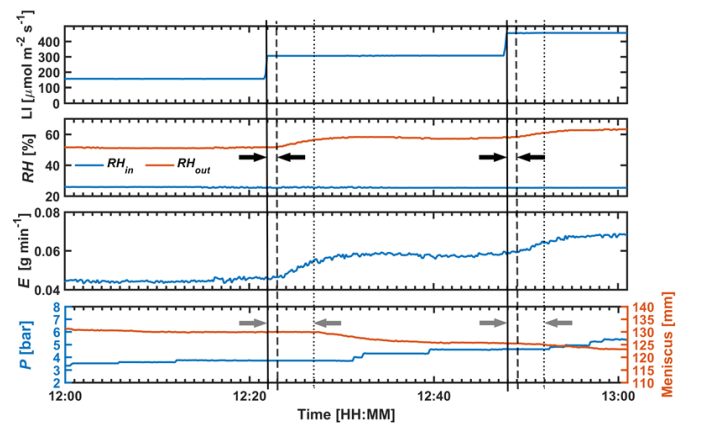
图3. 出风口相对湿度( RHout)、蒸腾速率(E,用RPCS测量)和半月板对光强(LI)和施加压力(P)变化的响应。黑色和灰色箭头之间的距 离表示光强改变后RHout和半月板变化的时间。
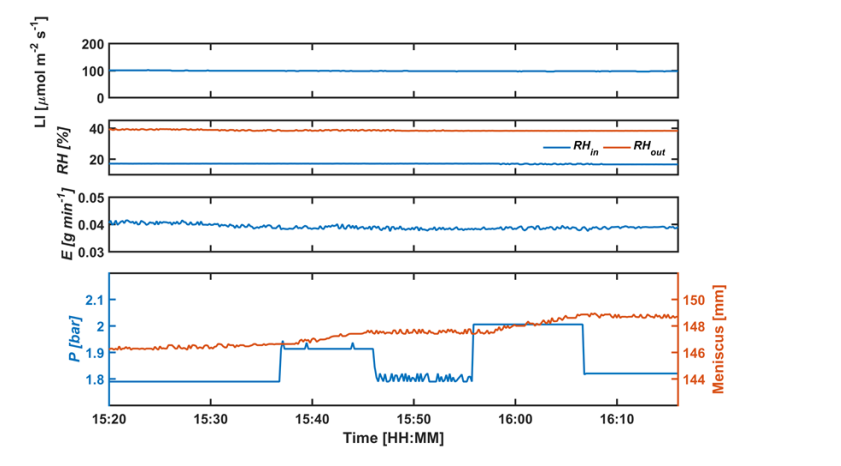
图4. 在恒定的光强( LI)和蒸腾速率(E)以及相应的相对湿度( RH)下,半月板对施加压力(P)的响应。RHin 和 RHout: 进出空气的相对湿度。
蒸腾速率和压力之间的关系
不同土壤水分条件下,蒸腾速率与施压力的关系如图5所示。 无论是湿润土壤还是相对干燥土壤,施压均随蒸腾速率线性增加,这与均匀湿润土壤和干燥土壤中羽扇豆的研究一致(Hayat et al., 2019)。 在高蒸腾速率和干燥土壤中,蒸腾速率与施压力的关系保持线性,这与之前对小麦和大麦的研究形成对比,在这些研究中,关系开始变得非线性(Carminati et al., 2017; Deery et al., 2013; Passioura, 1980)。 与小麦和大麦的迟滞现象相比珍珠谷子在蒸腾速率增加和减少阶段的压力差要小得多。随着土壤含水量的降低,植物水力阻力(Rplant)的斜率逐渐增大。坡度稍陡表明干燥土壤中植物水力导度有中度降低(Kplant = 1/Rplant)。
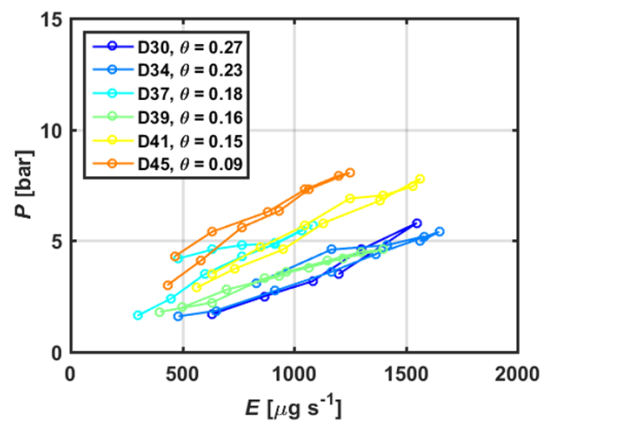
图 5. 土壤干燥过程中珍珠谷子蒸腾速率E与平衡压力P的关系。D: 播种后第二天, θ: 土壤含水量.
结果与展望
本研究建立了测量土壤干燥过程中叶片水势与蒸腾速率关系的根压室系统。该系统分辨率高( 0.1bar),能准确测量叶片水势,测量蒸腾速率可靠。结果表明,无论在湿润土壤还是相对干燥土壤中,珍珠谷子的蒸腾速率与平衡压力均呈线性关系,即使在高蒸腾速率下也是如此。随着土壤干燥,植物水力导度略有下降。
这项技术可以研究植物对严重的土壤干燥和灌溉的反应。此外,人们可以研究植物的水力导度如何受到环境条件的影响,如土壤类型或空气湿度,以及不同的根系性状,如根长密度或根毛(Carminati et al., 2017)。最后,可以测试不同耐旱性的植物的蒸腾速率(E)与平衡压力(P)之间的关系,如Kholová 等( 2010)测试的珍珠谷子。总之,该方法为研究植物对土壤水分胁迫的响应提供了新的机会。
参考文献
Carminati, A., Passioura, J.B., Zarebanadkouki, M., Ahmed, M.A., Ryan, P.R., Watt, M., and Delhaize, E. (2017). Roothairs enable high transpiration rates in drying soils. New Phytol. 216 (3), 771–781
https://doi.org/10.1111/nph.14715. PubMed
Chen, J., and Chen, C. (2017). Uncertainty analysis in humidity measurements by the psychrometer method.Sensors (Basel) 17 (2), 17 https://doi.org/10.3390/s17020368. PubMed
Deery, D.M., Passioura, J.B., Condon, J.R., and Katupitiya, A. (2013). Uptake of water from a Kandosol subsoil. II. Control of water uptake by roots. Plant Soil 368 (1-2), 649–667 https://doi.org/10.1007/s11104-013-1736-7.
Hayat, F., Ahmed, M.A., Zarebanadkouki, M., Cai, G., and Carminati, A. (2019). Measurements and simulation of leaf xylem water potential and root water uptake in heterogeneous soil water contents. Adv. Water Resour. 124, 96–105 https://doi.org/10.1016/j.advwatres.2018.12.009.
Iwasaki, N., Hori, K., and Ikuta, Y. (2019). Xylem plays an important role in regulating the leaf water potential and fruit quality of Meiwa kumquat (Fortunella crassifolia Swingle) trees under drought conditions. Agric. Water Manage. 214, 47–54 https://doi.org/10.1016/j.agwat.2018.12.026.
Javaux, M., Schrö der, T., Vanderborght, J., and Vereecken, H. (2008). Use of a Three-Dimensional Detailed Modeling Approach for Predicting Root Water Uptake. Vadose Zone J. 7 (3), 1079–1088
https://doi.org/10.2136/vzj2007.0115.
Kholová, J., Hash, C.T., Kumar, P.L., Yadav, R.S., Kocová, M., and Vadez, V. (2010). Terminal drought-tolerant pearl millet [Pennisetum glaucum (L.) R. Br.] have high leaf ABA and limit transpiration at high vapour pressure deficit. J.Exp. Bot. 61 (5), 1431–1440 https://doi.org/10.1093/jxb/erq013. PubMed
Kirkham, M.B. (2005). 16 - Measurement of Water Potential with Thermocouple Psychrometers. In Principles of Soil and Plant Water Relations, M.B. Kirkham, ed. (Burlington: Academic Press), p.241–262.
Matin, M.A., Brown, J.H., and Ferguson, H. (1989). Leaf water potential, relative water content, and diffusive resistance as screening techniques for drought resistance in barley. Agron. J. 81 (1), 100–105
https://doi.org/10.2134/agronj1989.00021962008100010018x.
Matzner, S., and Comstock, J. (2001). The temperature dependence of shoot hydraulic resistance: implications for stomatal behaviour and hydraulic limitation. Plant Cell Environ. 24
https://doi.org/10.1046/j.0016-8025.2001.00785.x. (12), 1299–1307
Montgomery, R., and McDowall, R. (2008). Sensors and auxiliary devices. In Fundamentals of HVAC Control Systems,Chapter 4, R. Montgomery, and R. McDowall, eds. (Oxford: Elsevier), p.106–159.
O’Toole, J.C., Turner, N.C., Namuco, O.P., Dingkuhn, M., and Gomez, K.A. (1984). Comparison of some crop water stress measurement methods. Crop Sci. 24 (6), 1121–1128
https://doi.org/10.2135/cropsci1984.0011183X002400060028x.
Oosterhuis, D.M., Savage, M.J., and Walker, S. (1983). Field use of in situ leaf psychrometers for monitoring water potential of a soybean crop. Field Crops Res. 7, 237–248
https://doi.org/10.1016/0378-4290(83)90033-3.
Parent, B., Suard, B., Serraj, R., and Tardieu, F. (2010). Rice leaf growth and water potential are resilient to evaporative demand and soil water deficit once the effects of root system are neutralized. Plant Cell Environ. 33
(8), 1256–1267 https://doi.org/10.1111/j.1365-3040.2010.02145.x. PubMed
Passioura, J. (1980). The transport of water from soil to shoot in wheat seedlings. J. Exp. Bot. 31 (1), 333–345
https://doi.org/10.1093/jxb/31.1.333.
Richter, H. (1997). Water relations of plants in the field: some comments on the measurement of selectedparameters. J. Exp. Bot. 48 (1), 1–7 https://doi.org/10.1093/jxb/48.1.1.
Saliendra, N.Z., Sperry, J.S., and Comstock, J.P. (1995). Influence of leaf water status on stomatal response to humidity, hydraulic conductance, and soil drought in Betula occidentalis. Planta 196 (2), 357–366
https://doi.org/10.1007/BF00201396.
Scholander, P.F., Bradstreet, E.D., Hemmingsen, E.A., and Hammel, H.T. (1965). Sap pressure in vascular plants:negative hydrostatic pressure can be measured in plants. Science 148 (3668), 339–346
https://doi.org/10.1126/science.148.3668.339. PubMed
Sperry, J.S., Hacke, U.G., Oren, R., and Comstock, J.P. (2002). Water deficits and hydraulic limits to leaf water supply.Plant Cell Environ. 25 (2), 251–263 https://doi.org/10.1046/j.0016-8025.2001.00799.x. PubMed
Tyree, M.T., and Hammel, H.T. (1972). The measurement of the turgor pressure and the water relations of plants by the pressure-bomb technique. J. Exp. Bot. 23 (1), 267–282 https://doi.org/10.1093/jxb/23.1.267.
Wullschleger, S.D., Dixon, M.A., and Oosterhuis, D.M. (1988). Field measurement of leaf water potential with a temperature-corrected in situ thermocouple psychrometer. Plant Cell Environ. 11 (3), 199–203
https://doi.org/10.1111/j.1365-3040.1988.tb01137.x.

